人民金融·创新药数据库监测显示,5月12日,智飞生物的母牛分枝杆菌疫苗(结核感染人群用)和人福医药的注射用磷丙泊酚二钠完成了第二轮补充资料,此前两款创新药已完成了生产现场检查,完成两轮发补后,有望在近期获批。
另外,在5月7日至5月13日的发布周期内,倍而达药业的三代EGFR抑制剂瑞泽替尼胶囊申报上市,信达生物、君实生物、恒瑞医药等的8个创新药首次获批临床。临床进展方面,沃森生物的mRNA新冠疫苗即将启动III期临床,四川大学华西医院和丽珠单抗的重组蛋白新冠疫苗II期临床也已接近尾声。
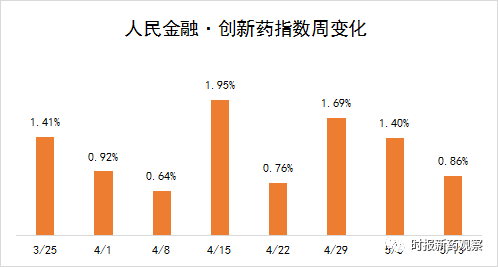
受这些因素影响,新发布周期内,我国创新药研发保持良好势头,“人民金融·创新药指数”涨0.86%,最新报1630.03点。
智飞生物、人福医药重磅新药临近获批
5月12日,智飞生物的母牛分枝杆菌疫苗(结核感染人群用)和人福医药的注射用磷丙泊酚二钠完成了第二轮补充资料,此前两款创新药已完成生产现场检查,完成两轮发补后,或即将进入行政审批阶段,有望在近期获批上市。
这两款创新药均有望成为重磅品种。丙泊酚是国内最大静脉麻醉剂品种,2019年终端市场规模50-60亿元。磷丙泊酚为丙泊酚前体,能在体内代谢产生丙泊酚,可有效解决丙泊酚蓄积毒性的问题,更安全、镇静效果更强。开源证券研报认为,人福医药的磷丙泊酚三期临床选择和丙泊酚的头对头试验,选择入组病人是全身麻醉下进行外科择期手术且需要气管插管的手术患者。假设获批后磷丙泊酚替代三分之一丙泊酚市场,未来终端销售额超15亿元。
母牛分枝杆菌疫苗(结核感染人群用)上市后有望为结核感染人群提供防护选择,对结核杆菌潜伏感染人群预防结核病意义重大。根据天风证券的测算,根据WHO的数据,若按1%的渗透率计算,母牛分枝杆菌疫苗(结核感染人群用)对应渗透目标人群为350万人,合理假设单人全6针花费2000元,产品上市后在中国市场潜力可达70亿元。
新发布周期内,倍而达药业的三代EGFR抑制剂瑞泽替尼胶囊上市申请获受理。今年3月,石药集团通过股权认购获得了瑞泽替尼的中国权益,并对倍而达药业进行2亿元的股权投资。
不过,当前国内的三代EGFR抑制剂竞争日渐激烈,不仅有新药持续加入,仿制药也即将进入市场。目前国内已有阿斯利康的奥希替尼、豪森药业的阿美替尼以及艾力斯的伏美替尼3款三代EGFR抑制剂获批,贝达药业的贝福替尼、倍而达药业的瑞泽替尼已报产,苏州润新生物的RX518处于III期临床,这几个品种有望在未来几年陆续获批上市。同时,奥希替尼仿制药也即将参与竞争,5月12日江苏万邦生化医药的甲磺酸奥希替尼片仿制药上市申请获受理,这是国内首个申报上市的奥希替尼仿制药。
沃森生物mRNA新冠疫苗即将进入三期临床
在新发布周期内,我国新冠疫苗的研发取得了新进展。公开信息显示,沃森生物的mRNA新冠疫苗即将启动III期临床,四川大学华西医院的重组蛋白新冠疫苗和丽珠集团控股附属公司丽珠单抗的重组蛋白新冠疫苗II期临床也已接近尾声。
Clinicaltrials.gov网站信息显示,上个月,沃森生物登记了一项mRNA新冠疫苗III期临床试验,临床登记号:NCT04847102。根据方案,沃森生物计划在全球招募约2.8万名18岁以上的志愿者,其中至少有25%的志愿者年龄在60岁以上。这些志愿者将被随机分配到研究组和对照组,分别接受两剂实验疫苗或安慰剂,间隔28天。该研究将于5月28日启动,预计初步完成日期是10月30日,完成日期是2023年5月30日。去年12月,沃森生物开工建设中国首个mRNA新冠疫苗生产车间,预计8个月内建成投产,一期产能为1.2亿剂/年。
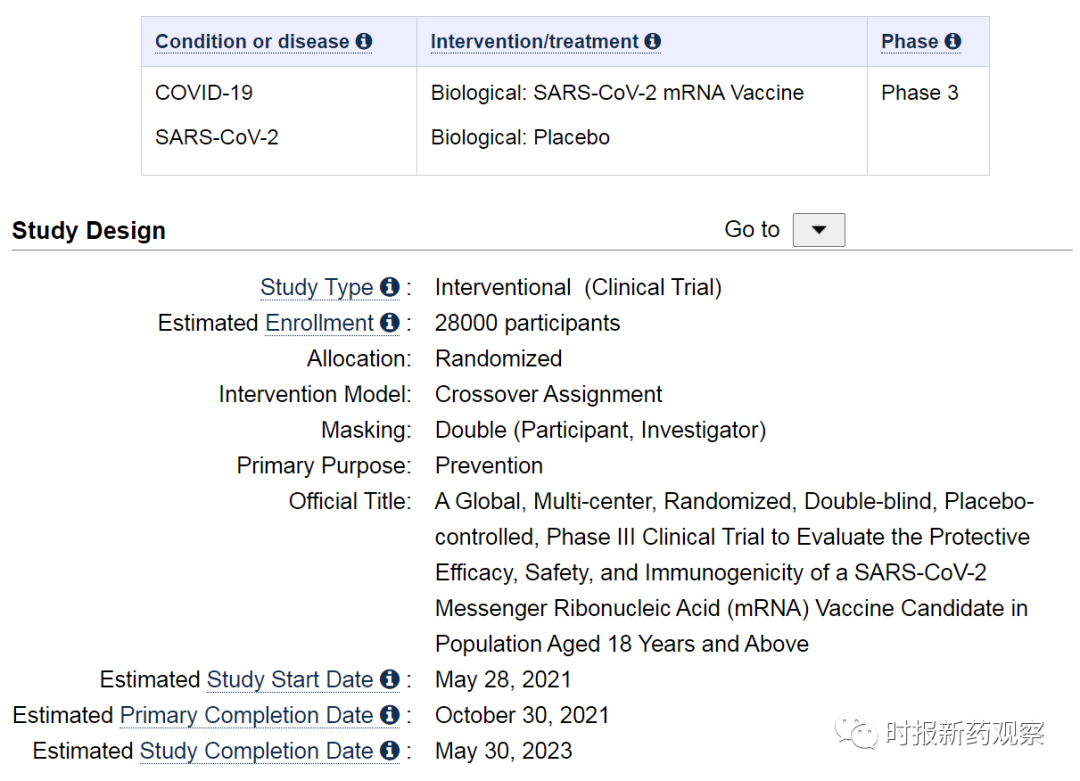
重组蛋白疫苗方面,四川大学华西医院重组新型冠状病毒肺炎疫苗(Sf9细胞)、丽珠单抗重组新型冠状病毒融合蛋白疫苗II期临床试验接近尾声。
Clinicaltrials.gov网站信息显示,今年1月,江苏省疾控中心登记了四川大学华西医院重组新型冠状病毒肺炎疫苗(Sf9细胞)Ⅱb临床试验,临床登记号:NCT04718467。根据方案,一共有4000名18岁至85岁的健康成人将分别接受安慰剂和三剂量的疫苗,该研究于2月1日启动,预计初步完成时间是5月15日。
与四川大学华西医院的新冠疫苗不同,丽珠单抗重组新型冠状病毒融合蛋白疫苗或采用两剂接种方式。中国临床试验注册中心网站信息显示,高州市疾控中心正在开展丽珠单抗的重组新型冠状病毒融合蛋白疫苗II期临床,成人和老人受试者各入组280例,这些受试者分别将接受安慰剂和两剂量的疫苗,两剂接种间隔21天。该临床试验于3月28日启动,从时间上看,受试者应已完成接种,临床试验已接近尾声。
信达生物第6款双抗获批临床
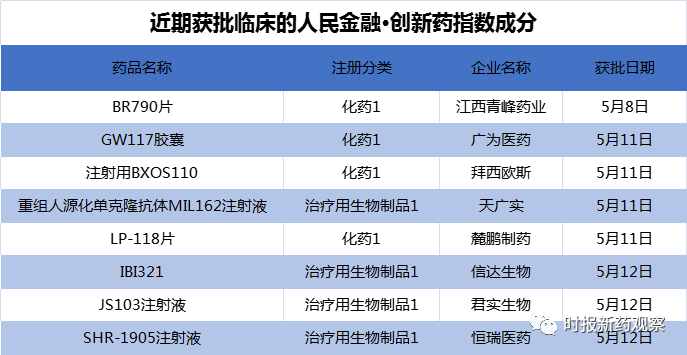
在5月7日至5月13日的发布周期内,来自信达生物、君实生物、恒瑞医药等的8个创新药首次获批临床,我们将这些品种纳入了“人民金融·创新药指数”。
5月12日,信达生物的IBI321临床试验申请获得临床默示许可,适应症为晚期恶性肿瘤。根据信达生物2020年报,IBI321为公司与礼来共同开发的新型PD-1/TIGIT双特异性抗体。
近年来,TIGIT免疫检查点蛋白成为癌症免疫疗法研发领域的热点之一。信达生物在TIGIT靶点的布局属于国内第一梯队,公司不仅是国内首个申报TIGIT单抗的企业,其PD-1/TIGIT双抗也是国内首个。同时,信达生物还是国内双抗布局最广的企业,共有6款双抗获批开展临床试验。在信达生物的双抗品种中,同时靶向PD-1/PD-L1的IBI318进展最快,于2020年11月登记启动了II/III期临床。
同日,恒瑞医药的1类新药SHR-1905注射液获批临床,适应症为哮喘。目前,恒瑞已有2款拟用于哮喘的单抗药物进入临床阶段,分别为靶向IL-4R的SHR-1819和靶向IL-5的SHR-1703,均处于I期临床。
君实生物5月12日晚间公告,其自主研发的聚乙二醇化尿酸酶衍生物JS103临床试验申请获得批准,将开展痛风适应症临床试验。公告称,根据《中国高尿酸血症与痛风诊疗指南(2019)》显示,中国高尿酸血症总体患病率为13.3%,痛风为1.1%,由高尿酸血症导致的痛风及相关疾病是中国高发的慢性病之一,JS103的开发有望为患者带来更多的治疗选择。
(文章来源:证券时报)







